เมนูนำทาง
กฎสัดส่วนพหุคูณ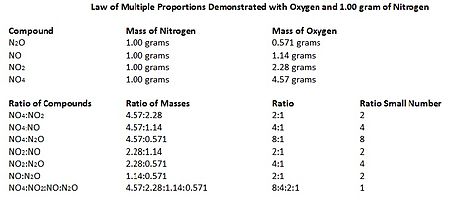

กฎสัดส่วนพหุคูณ
ในทางเคมี กฎสัดส่วนพหุคูณ (อังกฤษ: law of multiple proportions) เป็นกฎพื้นฐานของปริมาณสารสัมพันธ์ บางครั้งเรียกว่ากฎของดาลตัน ตามชื่อของจอห์น ดาลตันผู้ตั้งกฎดังกล่าวกฎสัดส่วนพหุคูณกล่าวว่า ถ้าธาตุสองชนิดสามารถรวมกันได้เป็นสารประกอบมากกว่าหนึ่งอย่าง กำหนดให้มวลของธาตุชนิดแรกคงที่ อัตราส่วนระหว่างมวลของธาตุชนิดที่สองในสารประกอบแต่ละชนิดที่ว่านั้นจะเป็นเลขจำนวนเต็มน้อยๆ เช่น สารประกอบออกไซด์ของคาร์บอน สองชนิด CO และ CO2 กำหนดให้คาร์บอนมีปริมาณ 100 กรัม ในสารประกอบทั้งสอง ในคาร์บอนมอนอกไซด์ (CO) มีออกซิเจน 133 กรัม ส่วนในคาร์บอนไดออกไซด์ (CO2) มีออกซิเจน 266 กรัม อัตราส่วนระหว่างมวลออกซิเจนในสารประกอบทั้งสอง คือ 266:133 ≈ 2:1 เป็นสัดส่วนระหว่างจำนวนเต็มน้อยๆ ตามกฎ
ใกล้เคียง
แหล่งที่มา
WikiPedia: กฎสัดส่วนพหุคูณ