เมนูนำทาง
กฎของแก๊สอุดมคติ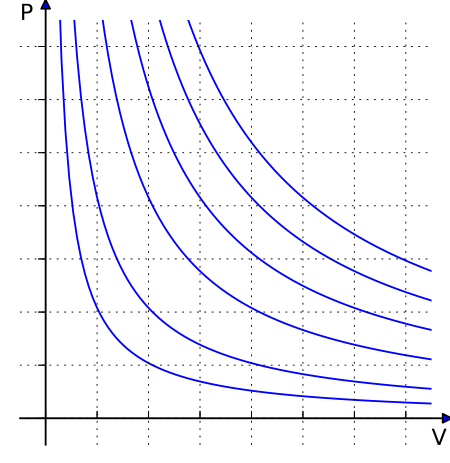

กฎของแก๊สอุดมคติ
กฎของแก๊สอุดมคติ (อังกฤษ: ideal gas law) บ้างก็เรียกว่า สมการแก๊สทั่วไป เป็นสมการของสภาวะ (equation of state) ของแก๊สอุดมคติ (ideal gas) สมมุติและเป็นการประมาณพฤติกรรมของแก๊สที่ดีภายใต้สภาวะต่าง ๆ แม้ยังมีข้อจำกัดอยู่หลายข้อ ถูกกล่าวถึงเป็นครั้งแรกโดย เบอนัว ปอล เอมีล กลาแปรง ในปี ค.ศ. 1834 เป็นการรวมกันของกฏของบอยล์ (Boyle's law), กฎของชาร์ล (Charles's law), กฎของอาโวกาโดร และกฎของแก-ลูว์ซัก (Gay-Lussac's law) ซึ่งเป็นเชิงประจักษ์[1] กฎของแก๊สอุดมคติมักถูกเขียนอยู่ในรูปเชิงประจักษ์:โดย P {\displaystyle P} , V {\displaystyle V} และ T {\displaystyle T} คือความดัน, ปริมาตร และอุณหภูมิ (Thermodynamic temperature) n {\displaystyle n} คือจำนวนของสสาร (amount of substance) และ R {\displaystyle R} คือค่าคงตัวของแก๊สซึ่งมีค่าเท่าเดิมไม่ว่าเป็นแก๊สชนิดใด เราสามารถอนุพัทธ์สมการนี้ได้จากทฤษฎีจลน์ของแก๊สในระดับจุลทรรศน์ดังเช่นที่ได้กระทำแล้ว (โดยอิสระจากกัน) โดย เอากุสต์ เครอนิค (August Krönig) ในปี ค.ศ. 1856[2] และ รูด็อล์ฟ เคลาซีอุส ในปี ค.ศ. 1857.[3]
ใกล้เคียง
แหล่งที่มา
WikiPedia: กฎของแก๊สอุดมคติ